伴随着新冠疫情在全球范围内旷日持久的影响,医学检测服务受到了极大关注并蓬勃发展。而其中,体外诊断产品[1]已成为医学检测服务中最普遍、最有代表性的产品之一。体外诊断产品的临床应用主要通过两种途径:一种是将经过国家药品监管部门审批注册的体外诊断产品提供给医疗机构,并由医疗机构按照国家卫健委相关要求向患者提供检测的IVD模式;另一种是由医学检验实验室自行研发、验证、生产体外诊断产品,并只在实验室内部使用的LDT模式。
2021年修订的《医疗器械监督管理条例》(以下简称“新规”)第53条规定,“对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用。具体管理办法由国务院药品监督管理部门会同国务院卫生主管部门制定”。"自行研制"且"在本单位内"使用的体外诊断试剂与上述LDT模式内涵相近,因此新规第53条被广泛解读为我国法律对LDT模式的认可。
新规第53条对LDT仅进行了概括式规定,具体操作细节目前立法上仍处于空白状态。结合当前立法现状,本文试图对新规出台后,我国LDT现行业务模式及其合规性进行梳理和分析。
一、 新规的立法意义及“留白”之处
新规出台前,我国对医疗器械实施注册或备案制,未经药监部门备案或注册的医疗器械原则上均不得销售、也不得为医疗机构使用,因此,LDT业务在法律上处于灰色地带,未形成充分商业化业务模式,实践中的案例相对较少。新规首次为LDT模式的合法性在一定程度上提供了法律依据,其在立法上被视为创新规定,但如上所述,新规第53条仅为原则性、概括性规定,对LDT的具体实操管理规定,立法上仍处于空白。新规“留白”之处主要体现在以下几处:
1.关于"国内尚无同品种产品上市"
我们理解,新规第53条的立法目的在于鼓励医检行业创新研发,进而推进个体化医学、精准医学的临床应用和发展,相比于对已经上市的产品进行更新提升,其更鼓励倡导对罕见病或偏向定制化、个性化检测产品的创新研发[2]。新规第53条仅提及了上市品种的有无,但如何认定、谁来认定“国内尚无同产品上市”?通过LDT模式对已上市产品进行优化或创新的产品是否属于前述产品范畴?这些实操问题有待后续管理办法予以明确。
2.关于"符合条件的医疗机构"及"自行研制"
医疗机构作为LDT的主要实施主体,应具备哪些条件?比如,资金、设备、研究场所、研究人员等方面应达到何种标准?除《医疗机构管理条例(2022修订)》中定义的医疗机构外,医学检验实验室作为单独设置的医疗机构,是否属于实施主体范畴?从事LDT业务的医疗机构是否需持有专项资质许可?
此外,如何理解和认定医疗机构“自行研制”?当前实践中,不少企业采用研发主体和医疗机构分离的组织架构;或将检测服务外包给具有独立医学实验室资质的企业;或与企业共建实验室,由企业方为医院搭建检测系统,包括设备、技术支持及人员培训等,前述研发主体和医疗机构分离的模式是否符合"自行研制"的要求?这些具体问题的认定和执行标准,直接关系到LDT业务模式的合规性认定。因此,在后续管理办法尚未出台前,企业与医疗机构合作开展LDT业务,合规性尚待确定。
3. 关于“在执业医师指导下在本单位内使用”
实践中最常见的"执业医师指导"即由执业医师进行问诊并处方。目前相当多的LDT企业与医院合作,由医院(而非LDT企业的医学检验实验室)的执业医师向患者处方一项检测,具体的检测由LDT企业的医学检验实验室开展,并且向医院/患者反馈检测结果。这种方式是否符合"执业医师指导"?执业医生应具备哪些条件?医疗机构在执业医师数量上有哪些具体要求?此外,如何理解“本单位”?“本单位”是仅指具体开展LDT研制和应用的医疗机构,还是包括“同一集团内设医疗机构”的企业?这些具体问题的理解和认定一定程度上也关乎LDT业务模式的合规性,均有待后续管理办法予以明确。
二、 LDT与IVD的比较分析
在梳理、介绍我国LDT现有业务模式前,我们对LDT与IVD两种模式作如下简要比较分析:
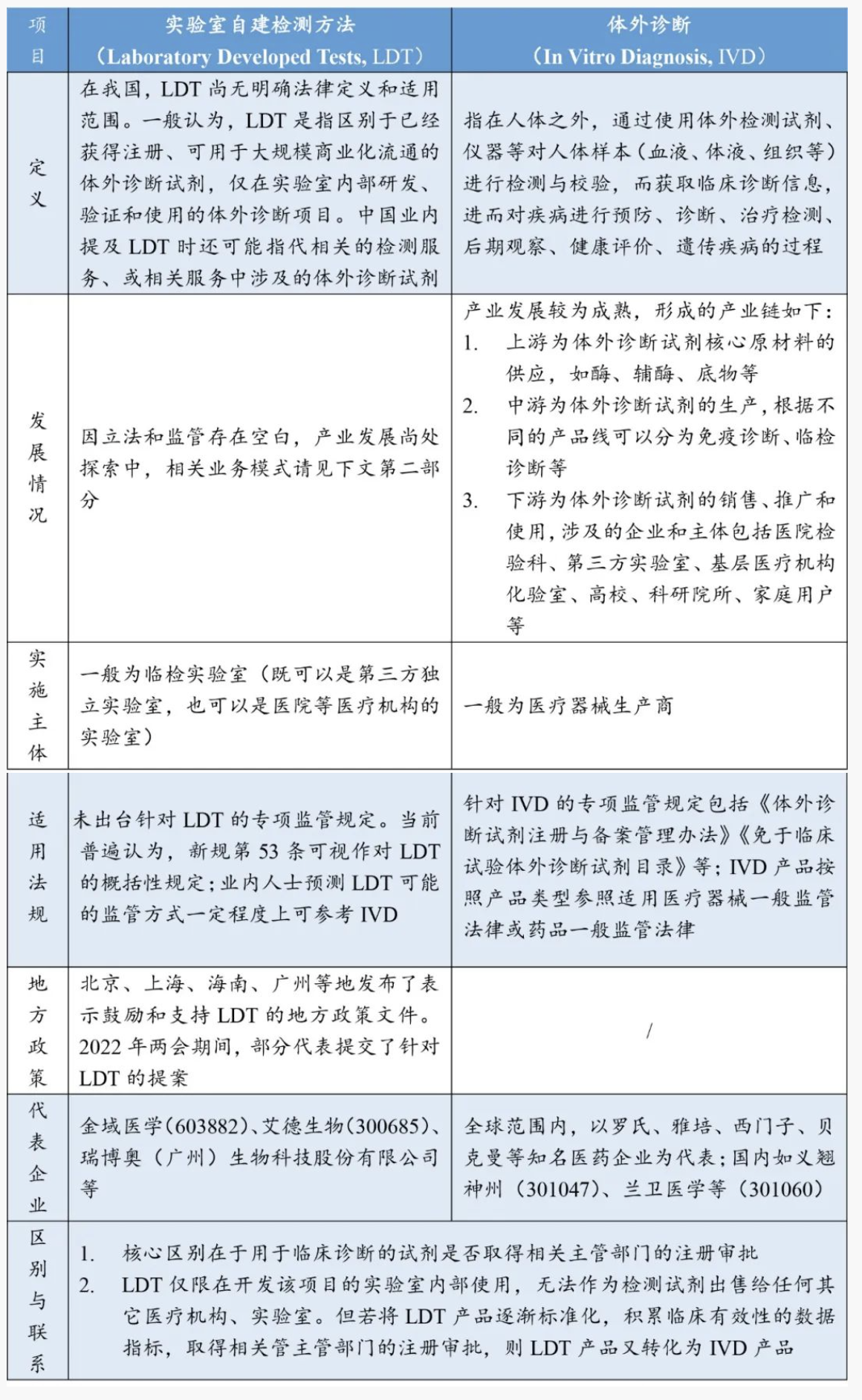
三、LDT现有业务模式及其合规性探析
1.医疗机构内部“自产自销”
如上文所述,新规出台前,LDT业务处于受限制状态,医疗机构很少自身开展LDT相关研究及业务。参考上海市临检中心对全市二级甲等及以上医疗机构和独立实验室及社会办医院共115家机构开展临床实验室白建检测方法的现况进行的问卷调查,仅有19家医疗机构反馈开展了临床实验室自建检测,其中三级医疗机构16家、二级医疗机构1家、其他医疗机构2家。
新规出台后,我们认为,由医疗机构内部开展LDT研究并进行应用是最为符合新规第53条规定的业务模式。但当前常见的LDT业务主体(如医院以及第三方医学检验中心)均很难单独满足开展该业务的全部要求。例如:开展LDT业务既需要满足实验设备自动化、高精度技术的要求,又要符合医疗机构管理规范,同时又要面临极大的前期投入,而大部分具备科研能力的医院属于非营利性的事业单位,对于医院相关科室(如检验科)而言,LDT的研制是超出现有的业务范围的,医院很难获得相应资金并建立完整的LDT研究环境。而第三方医学检验中心一般已经配备了研发部门,方便开展一些LDT项目的研制,但其又很难像医院一样接触到大量的终端用户,且如果仅能在“本单位”内部使用的情况下,其商业收益很难达到预期。因此,此模式虽最为符合新规第53条字面上的要求,但缺乏实操基础。
2. LDT to IVD
根据新规第53条,LDT研制的体外诊断试剂应为"无同品种上市产品",对于企业而言,LDT模式是对诊断试剂产品注册流程赶不上临床需求这一无奈现实的一项有限补充,因此,部分企业将LDT作为IVD模式的前置或过渡环节。
如兰卫医学(301060)在其披露的《关于2022年度向特定对象发行股票募集资金使用的可行性分析报告》中称,该公司形成了“实验室研究 to LDT to IVD”的创新模式。华大基因(300676)也在其披露文件中表示,公司已明确基因和位点的疾病检测技术可以进行IVD产品的报证,而暂时无法纳入审批范围内的检测技术,短期内将倾向于采用LDT模式以满足临床精准检测需求。此外,诺辉健康(股票代码06606.HK)在其《招股说明书》中披露,诺辉健康2016年12月开始直接或通过如医院、体检中心、保险公司、药房及在线渠道向个别人士提供常卫清(结直肠癌筛查)测试服务(作为LDT服务),公司自常卫清产品于2020年11月取得国家药监局注册批准后将LDT服务转为医疗服务。
结合前文所述LDT模式与IVD模式之间的区别,考虑到LDT相对难度较低、研发周期较短的特点,实践中,LDT模式与IVD模式常处于过渡衔接状态。该模式下,即使最终相关产品获得了国家药监局注册批准,如上文所述立法空白原因,IVD之前的LDT模式的合规性仍存在不确定性。诺辉健康也在其招股说明书中披露公司“就LDT服务事项向国家卫生健康委员会、国家药品监督管理局进行政府咨询,其将不会因过往提供LDT服务而受到国家卫生健康委员会的处罚,国家药品监督管理局不会直接监管LDT服务”,这也侧面印证,此模式下,LDT合规性存在不确定性。
3. 合作外包模式
除医疗机构内部“自产自销”外,常见的开展LDT业务主体为第三方实验室,采用的是研发主体与医疗机构分离的业务模式,即由医疗机构从第三方实验室(实务中部分第三方实验室为集团内部公司,由集团内部采购LDT试剂供集团内部的医疗主体使用)采购LDT试剂后进行使用。此外,目前还有LDT企业与医院采取医院挂牌建立联合实验室的商业模式,即由LDT企业提供检测设备、试剂,由医院向病人开单检测并向LDT企业支付技术服务费等。
此模式可以有效利用资源并达到合作共赢的目的,但如上文所述立法空白原因,此模式的合规性存在不确定性。
4. 海外运营模式
为避免国内现行监管体系下LDT合规性风险,有的中国企业选择在美国等LDT监管及实践较为完善的国家设立子公司,通过海外子公司开展LDT业务。例如,瑞博奥(广州)生物科技股份有限公司在其IPO招股说明书中披露,其美国子公司Panohealth已获得CLIA实验室资质,并采用公司自主研发的产品,对外提供实验室研发检测(LDTs)服务,包括新冠核酸检测服务及新冠病毒抗体水平检测。
我们认为,海外运营模式在当前情况下,对于有条件的中国企业而言,不失为一个可选模式,但境外子公司开展LDT业务,应当遵守并符合所在国家或地区相关法律法规要求(如美国开展LDT业务便需要取得医学实验室资质证书及CLIA证书)。如境内中国企业拟实施境内IPO或再融资,证券审核部门仍会关注发行主体境外子公司业务合规性问题,发行人应聘请境外子公司所在地有资质的专业机构,对其境外子公司在所在国家或地区开展LDT业务的合规性予以核查并发表明确意见。
四、总结
新规的出台为我国开展LDT提供了法律依据,但LDT在实操层面,仍缺乏具体监管法规,当下,LDT业务合规性问题仍是实施主体面临的最大风险之一。建议开展LDT业务的企业,密切关注立法及监管最新动态,提高创新和研发能力,养精蓄税,蓄势待发。
(注:本文首发于律商网)
注释:
[1] 体外诊断产品主要由诊断仪器和诊断试剂构成,根据《医疗器械分类目录》《体外诊断试剂分类规则》《医疗器械临床试验质量管理规范》等法律法规,除国家有明确界定的IVD仪器以及按照药品管理的用于血源筛查的IVD试剂、采用放射性核素标记的IVD试剂外,体外诊断产品一般均按照医疗器械进行监管。
[2] 例如艾德生物(300685)在其2022年度半年报中披露,公司下设实验室可根据客户需求进行定制化LDT产品开发,完成了众多知名药企重要肿瘤药物的临床研究服务工作。
依据《国家卫生计生委关于印发医学检验实验室基本标准和管理规范(试行)的通知》,医学检验实验室为单独设置的医疗机构。
 联系我们
联系我们
 关注公众号
关注公众号
 联系我们
联系我们